Notera att detta är en översiktsartikel med flera underartiklar. Använd menyn till vänster för att nå resterande artiklar.
Hittills i kemin kan det ha verkat som att en reaktion från ett ämne till ett annat alltid sker helt ut (vilket kallas för en stökiometrisk reaktion). Detta är inte helt sant. Det finns alltid en reaktion som går åt motsatt håll. Denna kan vara större eller mindre beroende på hur energirika och många de olika ämnena är, men den finns alltid där.
Kemisk jämvikt uppstår då dessa två motsatta reaktioner går lika snabbt. Det har då uppstått en jämvikt, och det varken skapas eller förbrukas mer av reaktant eller produkt. Beroende på reaktion ligger denna jämvikt på olika ställen. Jämvikten kan exempelvis infalla när det finns 50 % av reaktant, och 50% av produkt, eller vid helt andra procentvärden.
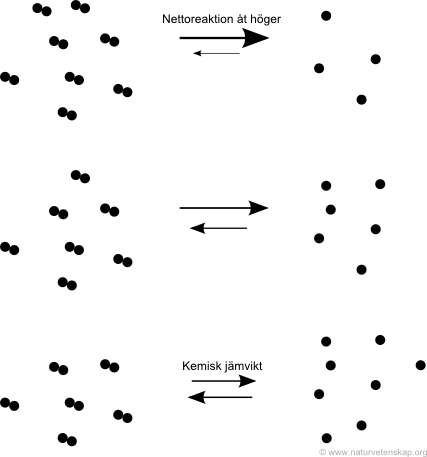
Bilden nedan kan ses som en hjälp till att förstå kemisk jämvikt. I reaktionen från vänster till höger delas ett ämne upp i två andra. Detta sker med en viss hastighet. Reaktionen från höger till vänster sätter ihop de två ämnena igen. Detta sker med en viss annan hastighet. När det går lika snabbt att bryta isär ämnet (reaktionen åt höger) som det går att sätta ihop det igen (reaktionen åt vänster) har vi nått kemisk jämvikt.
Under titeln ”Kemisk jämvikt” i menyn till vänster hittar du resterande artiklar om ämnet.