Oktettregeln är en regel som säger att en atom är som mest stabil när den har 8 valenselektroner i sitt yttersta elektronskal (så kallat ädelgasskal). Detta kan ske antingen genom hela elektronövergångar där joner bildas, eller via kovalenta bindningar där elektroner delas mellan atomerna i bindningen.
Reaktioner som gör kemiska föreningar mer stabila resulterar ofta (men inte alltid) i ädelgasskal. Oktettregeln är en observation att stabila kemiska föreningar oftast har ädelgasskal. Oktettregeln är alltså inte en kemisk drivkraft i sig.
Det finns ämnen som uppfyller oktettregeln men inte är stabila (exempelvis Li7−), och ämnen som är stabila trots att de inte uppfyller oktettregeln (exempelvis sulfatjonen SO42−).
Undantag
Ett undantag i oktettregeln finns för de minsta atomerna. K-skalet kan inte innehålla fler än två valenselektroner, vilket gör att det där istället tillämpas duettregeln. I övrigt är principen densamma.
Hur oktettregeln används
Oktettregeln används främst som ett verktyg för att snabbt ta reda på laddningar för atomjoner, och hur många kovalenta bindningar som kan skapas mellan atomer. Det är en bra idé att ha ett periodiskt system till hands för detta.
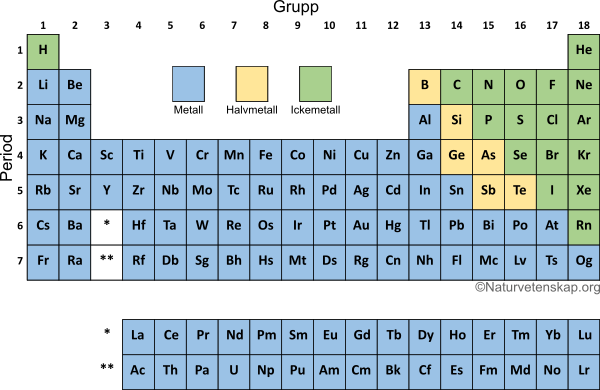
Joner
Om en atom har två valenselektroner, exempelvis magnesium (Mg) kan vi konstatera att det enklaste sättet för den att bli till en jon är att avge två elektroner, och därefter ha ett fullt valensskal (ett skal under det tidigare valensskalet). Magnesiumjonen har alltså en tvåvärt positiv laddning: Mg2+.
På samma vis kan vi se att en atom med 7 valenselektroner, exempelvis brom (Br) behöver ta upp en elektron för att få ett ädelgasskal, och blir envärt negativt laddad: Br−.
En atom kan alltså avge eller ta upp elektroner tills den har 8 elektroner i sitt yttersta elektronskal. Om de tar upp eller avger elektroner avgörs av vilket som kräver minst antal elektronövergångar. Atomer med 1-3 valenselektroner avger elektroner, och atomer med 5-7 valenselektroner tar upp elektroner. Atomer med 4 valenselektroner blir sällan till joner. Dessa riktlinjer gäller dock inte för övergångsmetallerna.
Du kan finna mer om hur joner bildas i denna artikel.
Kovalenta bindningar
Till skillnad från joner, som bildas genom hela elektronövergångar, är kovalenta bindningar en form av delning av valenselektroner. Varje kovalent bindning innehåller två elektroner, och dessa delas mellan de båda atomerna i bindningen. Nettoeffekten är att varje atom i bindningen får ett tillskott av en elektron, vilket för dem närmare ett valensskal med 8 valenselektroner. Exempelvis kan kol (C) med sina 4 valenselektroner skapa 4 kovalenta bindningar (en extra valenselektron per bindning) för att nå 8 valenselektroner. Brom (Br) med 7 valenselektroner kan skapa en kovalent bindning.
Du kan läsa mer om kovalenta bindningar här.
Ursprung
Oktettregeln är baserad på hur orbitaler fungerar. Detta gås dock inte igenom i gymnasiekemin. Du kan läsa mer om orbitaler på denna länk.
Sammanfattning

Övningsuppgifter
a) Hur många valenselektroner har en kväveatom (N)? Ta hjälp av periodiska systemet.
b) Om kväve ska bli till en jon, vilken laddning hade den då fått enligt oktettregeln?
c) Om kväve istället binder med kovalenta bindningar, hur många bindningar kan den skapa (baserat på oktettregeln)?
a) Kväve ligger i grupp 15. Det innebär att den har 5 valenselektroner.
b) För att nå ädelgasskal tar kväve upp tre elektroner, och blir trevärt negativt laddad.
5 elektroner (från början) + 3 elektroner (tas upp) = 8 elektroner (ädelgasskal).
c) Varje kovalent bindning ger ett tillskott på en valenselektron. Då kväve behöver tre extra valenselektroner för ädelgasskal kommer den att bilda tre kovalenta bindningar till andra atomer.
Förklara med hjälp av oktettregeln varför den kemiska föreningen CCl5 inte existerar.
Kol ligger i grupp 14 och har 4 valenselektroner. Kol kan skapa 4 kovalenta bindningar för att få ädelgasskal.
Klor ligger i grupp 17 och har 7 valenselektroner. Klor kan skapa 1 kovalent bindning för att få ädelgasskal.
Det finns inga sätt att kombinera ihop 1 kolatom och 5 kloratomer till en fungerande molekyl. Den maximala mängden klor vi kan binda till kol med hjälp av kovalenta bindningar är 4, och därefter kan det resterande kloret inte binda till varken kol eller klor.

Karbonatjonen (CO32−) är en vanlig jon inom kemin. Den innehåller både kovalenta bindningar och är elektriskt laddad, vilket innebär att det är en molekyljon. Du vet att jonen har ett överskott på två elektroner (i och med tvåvärd negativ laddning), och att kolatomen är den centrala atomen i föreningen. Rita upp elektronfördelningen för karbonatjonen med hjälp av oktettregeln.
Tänk på att en förening även kan innehålla dubbelbindningar, där totalt fyra elektroner ingår (två från ena atomen, och två från den andra).
Vi vet att kolatomen är central. Vi har även två elektroner i överskott. Vi börjar med att rita ut det vi vet, dvs att syreatomerna binder till kolatomen:
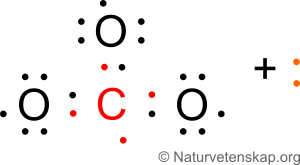
Vi ser att varje syre har tillgång till 7 valenselektroner. Kol har också tillgång till 7 valenselektroner. Oktettregeln uppfylls inte på någon av atomerna. Om vi hade lagt till de två extra elektronerna hade vi fortfarande inte lyckats ge alla fyra atomer ädelgasskal. Det behövs i detta fall en extra bindning från kol till en av syreatomerna (en så kallad dubbelbindning, där totalt 4 elektroner är involverade):
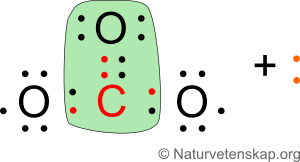
Nu uppfyller kolet och det översta syret oktettregeln, vilket vi indikerar i grönt i bilden ovan. Nu kan vi placera in de två kvarvarande elektronerna på de två nedre syreatomerna:

Nu uppfylls oktettregeln på alla atomer i karbonatjonen. Till höger i bilden ovan ses en mer avskalad bild av karbonatjonen, vilket är hur den vanligtvis presenteras när man ser den (fria elektronpar ritas inte ut).
Överkurs: När du kommer in på organisk kemi kommer du att upptäcka att karbonatjonen har något som kallas för resonansformer, vilket innebär att dubbelbindningen utspridd mellan de olika syreatomerna.