En strukturformel är en förenklad bild på hur atomer binder kovalent till varandra. Det finns många olika varianter på strukturformler, och i denna artikeln ska vi översiktligt gå igenom de delar som finns med i alla strukturformler.
Det första man behöver veta innan man kan förstå en strukturformel är att alla atomslag motsvaras av en viss förkortning, som du hittar i det periodiska systemet. Om du kollar på ett periodiskt system kan du se vad alla atomer har för en- eller tvåbokstavskod, och även i vilka grupper de ligger.
Olika atomer kan binda olika mycket
Baserat på i vilken grupp atomen ligger i på det periodiska systemet kan man bedöma hur många kovalenta bindningar den kan skapa.
- Atomerna i grupp 1 (alkalimetallerna) brukar inte binda kovalent. Ett undantag är väte (H), som kan skapa en kovalent bindning.
- Atomerna i grupp 2 (alkaliska jordartsmetaller) binder inte kovalent.
- Atomerna i grupp 3-12 (övergångsmetallerna) binder inte kovalent.
- Atomerna i grupp 13 (borgruppen) binder vanligtvis inte kovalent. Ett undantag är bor (B), som kan skapa tre kovalenta bindningar.
- Atomerna i grupp 14 (kolgruppen) binder ofta kovalent. Kol (C) och kisel (Si) skapar vanligtvis fyra kovalenta bindningar.
- Atomerna i grupp 15 (kvävegruppen) binder ofta kovalent. Kväve (N) och fosfor (P) skapar vanligtvis tre kovalenta bindningar.
- Atomerna i grupp 16 (syregruppen) binder ofta kovalent. Syre (O) och svavel (S) skapar vanligtvis två kovalenta bindningar.
- Atomerna i grupp 17 (halogenerna) binder ofta kovalent. Fluor (F), klor (Cl), brom (Br) och jod (I) skapar vanligtvis en kovalent bindning.
- Atomerna i grupp 18 (ädelgaserna) har ett fullt yttre elektronskal, och binder inte kovalent.
Hur en bindning ser ut
För att visa hur atomerna binder till varandra använder man sig raka streck mellan dem.
 Ett rakt streck mellan två atomer betyder att det en en enkel kovalent bindning (enkelbindning), som består av totalt två elektroner. I bilden till höger kan du se föreningen etan, vilken bara innehåller enkelbindningar. Kol (C) är en atom som ligger i grupp 14 och därmed kan skapa fyra kovalenta bindningar. Väte (H) kan skapa en kovalent bindning.
Ett rakt streck mellan två atomer betyder att det en en enkel kovalent bindning (enkelbindning), som består av totalt två elektroner. I bilden till höger kan du se föreningen etan, vilken bara innehåller enkelbindningar. Kol (C) är en atom som ligger i grupp 14 och därmed kan skapa fyra kovalenta bindningar. Väte (H) kan skapa en kovalent bindning.
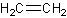 Två parallella streck mellan två atomer betyder att det är en dubbelbindning, som består av totalt fyra elektroner. En dubbelbindning innehåller mer energi än en enkelbindning, och kan reagera med andra ämnen på diverse sätt. I bilden till höger kan du se föreningen eten, vilken innehåller en dubbelbindning mellan de två kolatomerna. Då kol totalt kan skapa fyra bindningar, kan den bara binda till två väten då två bindningar redan är upptagna i och med dubbelbindningen.
Två parallella streck mellan två atomer betyder att det är en dubbelbindning, som består av totalt fyra elektroner. En dubbelbindning innehåller mer energi än en enkelbindning, och kan reagera med andra ämnen på diverse sätt. I bilden till höger kan du se föreningen eten, vilken innehåller en dubbelbindning mellan de två kolatomerna. Då kol totalt kan skapa fyra bindningar, kan den bara binda till två väten då två bindningar redan är upptagna i och med dubbelbindningen.
![]() Tre parallella streck mellan två atomer betyder att det är en trippelbindning, som består av totalt sex elektroner. En trippelbindning innehåller mer energi än en dubbelbindning, och kan reagera med andra ämnen på diverse sätt. I bilden till höger kan du se föreningen etyn, vilken innehåller en trippelbindning mellan de två kolatomerna. Kol kan som tidigare nämnt ha totalt fyra bindningar, och tre är upptagna i trippelbindningen. Den kvarvarande bindningen går till en väteatom.
Tre parallella streck mellan två atomer betyder att det är en trippelbindning, som består av totalt sex elektroner. En trippelbindning innehåller mer energi än en dubbelbindning, och kan reagera med andra ämnen på diverse sätt. I bilden till höger kan du se föreningen etyn, vilken innehåller en trippelbindning mellan de två kolatomerna. Kol kan som tidigare nämnt ha totalt fyra bindningar, och tre är upptagna i trippelbindningen. Den kvarvarande bindningen går till en väteatom.
Grupper komprimeras
 Det tar givetvis en hel del tid att skriva ut alla väten i en strukturformel, och av den anledningen komprimerar man ofta väte till att skrivas på samma ställe som kolatomen finns. När man komprimerar väten ser det ut som på bilden till höger. Den övre och undre strukturen beskriver samma förening. Bindningarna mellan kolatomerna finns kvar, men man har stoppat in vätena på ett sätt som de brukar skrivas i reaktionsformler.
Det tar givetvis en hel del tid att skriva ut alla väten i en strukturformel, och av den anledningen komprimerar man ofta väte till att skrivas på samma ställe som kolatomen finns. När man komprimerar väten ser det ut som på bilden till höger. Den övre och undre strukturen beskriver samma förening. Bindningarna mellan kolatomerna finns kvar, men man har stoppat in vätena på ett sätt som de brukar skrivas i reaktionsformler.
Notera att man på kolatomen till vänster skriver vätena till vänster istället för till höger om kolatomen. Detta görs för att få strukturformeln att se mer verklighetstrogen ut, och att man enkelt kan se var kolskelettet tar slut på vänster sida.
 Två andra strukturer som ofta förkortas är amingruppen och karboxylgruppen.
Två andra strukturer som ofta förkortas är amingruppen och karboxylgruppen.
Amingruppen förkortas \( \mathrm -NH_2\) om den sitter på ett kol som pekar åt höger, uppåt eller nedåt, och \( \mathrm H_2N-\) om den sitter på ett kol som sitter längst till vänster. I bilden motsvarar R en valfri resterande molekyl.
Karboxylgruppen förkortas \( \mathrm -COOH\) om den sitter på ett kol som pekar åt höger, uppåt eller nedåt, och \( \mathrm HOOC-\) om den sitter på ett kol som sitter längst till vänster.
Även laddning skrivs ut
Det är inte alltid så enkelt att allt är oladdat i en strukturformel. När en atom på något vis blir laddad måste detta skrivas in i strukturformeln.
En laddning uppstår ofta på grund av föreningen är en syra eller bas, och därmed har plockat upp eller gett ifrån sig H+, vilket kan göra att vissa atomer blir laddade.
Generellt kan man säga att:
- Om en atom har fler kovalenta bindningar än den vanligtvis ska ha, blir den positivt laddad.
- Om en atom har mindre kovalenta bindningar än den vanligtvis ska ha, blir den negativt laddad.
Påståendena ovan gäller för både syror och baser, men även för andra exempel på föreningar.
 I bilden till höger kan du se vad som händer med ättiksyra när den deprotoneras. Det kvarvarande syret har bara en bindning, vilket betyder att den har en mindre än den brukar ha, och därmed är negativt laddat. Laddningen skrivs ut på den atom som är laddad, och i denna bild är det ett minustecken vid syret längst till höger.
I bilden till höger kan du se vad som händer med ättiksyra när den deprotoneras. Det kvarvarande syret har bara en bindning, vilket betyder att den har en mindre än den brukar ha, och därmed är negativt laddat. Laddningen skrivs ut på den atom som är laddad, och i denna bild är det ett minustecken vid syret längst till höger.
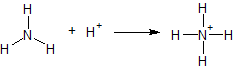 På samma sätt blir en atom som har fler bindningar än den brukar ha, positiv. Detta kan enkelt visas genom en basreaktion, där ammoniak tar upp en proton och blir till ammonium. Då kvävet har fyra bindingar istället för dess vanliga tre, blir det positivt laddat. Laddningen skrivs ut som ett plustecken vid kväveatomen.
På samma sätt blir en atom som har fler bindningar än den brukar ha, positiv. Detta kan enkelt visas genom en basreaktion, där ammoniak tar upp en proton och blir till ammonium. Då kvävet har fyra bindingar istället för dess vanliga tre, blir det positivt laddat. Laddningen skrivs ut som ett plustecken vid kväveatomen.
Nästa artikel handlar om Lewisstrukturer, vilket är en typ av strukturformel med alla elektroner utplacerade.